Периодический закон — одна из важнейших открытий в истории химии. Этот закон был открыт выдающимся русским химиком Дмитрием Ивановичем Менделеевым в середине XIX века. Он сформулировал основные принципы и закономерности, которые лежат в основе периодической системы химических элементов.
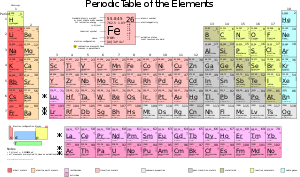
Периодическая система химических элементов — это систематическое представление всех известных химических элементов, упорядоченных по возрастанию их атомных номеров. Она позволяет систематизировать и классифицировать элементы в соответствии с их физическими и химическими свойствами. Периодическая система Менделеева включает не только самые известные элементы, такие как углерод, кислород, железо, но и те, которые были открыты позже.
Строение атома по Д.И. Менделееву — основано на представлении атома как неделимой частицы, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг ядра. Менделеев предложил также терминологию для обозначения атомных структур и элементов, в том числе таблицу с периодическим расположением элементов.
Периодический закон и его значения
Значение периодического закона заключается в возможности предсказать и систематизировать свойства и характеристики химических элементов на основе их расположения в периодической системе. Систематическое расположение элементов позволяет установить их сходство и различия, легко определить химическую реакционную способность и использовать эту информацию для прогнозирования и создания новых веществ.
Периодический закон позволяет вычислить атомное строение элементов и предсказать их свойства, а также объяснить закономерности в химических реакциях и составе вещества.
Значение периодического закона не ограничивается только химической наукой. Он имеет и практическую значимость. Так, благодаря периодическому закону была создана периодическая система химических элементов, которая является основой для изучения химии и других наук, таких как физика и биология.
Важно отметить, что разработка периодического закона была одним из крупнейших достижений российского химика Д.И. Менделеева. Его работа стала основой для создания периодической системы, которая облегчила не только изучение химии, но и углубила наше понимание мироздания и его строения.
Определение и основные принципы
Основными принципами Периодического закона являются:
1. Повторение свойств. Свойства химических элементов, как физические, так и химические, периодически повторяются с изменением их атомного номера.
2. Постепенное изменение свойств. Свойства элементов меняются постепенно, по мере перехода от одного элемента к другому в Периодической таблице. Поэтому, близкие элементы имеют схожие свойства.
3. Внутренняя структура атомов. Периодический закон основан на представлении атома по Д.И. Менделееву, согласно которому атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, расположенных на энергетических уровнях.
4. Постепенное изменение размеров и зарядов. Свойства элементов связаны с их атомными размерами и зарядами. Периодически изменяются как размеры атомов, так и их заряды. Например, по мере перехода от левого крайнего элемента периода к правому крайнему элементу, атомные радиусы уменьшаются, а заряд ядра увеличивается.
5. Периодические закономерности. В Периодической системе химических элементов можно выявить закономерности в расположении элементов и их свойствах. Например, каждый новый период начинается с элемента, у которого электронная оболочка заполняется новым электроном.
Понимание и применение периодического закона и основных принципов, на которых он основан, позволяют нам классифицировать и систематизировать химические элементы, а также предсказывать и объяснять их свойства и реактивность.
Периодический закон в химии — основной закон природы
В основе периодического закона лежит закономерность изменения химических свойств элементов при изменении их атомных номеров. Согласно периодическому закону, химические свойства элементов повторяются периодически с увеличением атомных номеров.
Периодический закон позволяет классифицировать химические элементы в периодической системе и предсказывать их химические свойства. Он является фундаментальной основой для понимания строения и свойств атомов, молекул и веществ.
Периодический закон в химии отражает глубокую закономерность в устройстве и функционировании материи. Он демонстрирует единство и объединение различных элементов в единый организованный мир.
| Период | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|
| 1 | H | Li | Be | Na | Mg | K |
| 2 | Na | K | Ca | |||
| 3 | K | Ca | Sr | |||
| 4 | Ca | Sr | ||||
| 5 | Sr | |||||
| 6 | Sr | |||||
| 7 | Pb |
Строение таблицы Менделеева и его значение
Основная особенность таблицы Менделеева заключается в её периодическом строении, когда элементы разделены на периоды (горизонтальные ряды) и группы (вертикальные столбцы). Такое строение позволяет увидеть закономерности в свойствах элементов и провести анализ их химической активности и взаимодействия.
Каждый элемент таблицы Менделеева представлен символом и атомным номером, который указывает на количество протонов в ядре атома. Помимо этого, в таблице указана также относительная атомная масса элемента.
Значение таблицы Менделеева в науке и промышленности трудно переоценить. Она является фундаментальным инструментом для изучения и классификации элементов, предсказания исходных условий и результатов химических реакций, разработки новых материалов и веществ.
Благодаря уникальному строению таблицы Менделеева ученые смогли обнаружить закономерности в химических свойствах элементов, выявить группы элементов с сходными свойствами и предсказать существование новых элементов, которые впоследствии были открыты и подтверждены экспериментально.
Таким образом, таблица Менделеева является фундаментальным инструментом для понимания строения и свойств атома и ядра, а также для развития современной химической науки и промышленности.
Взаимосвязь химических элементов в периодической таблице
Основной закономерностью периодической таблицы является периодичность химических свойств элементов. Это означает, что свойства элементов меняются по мере движения вдоль периодов и взаимодействия внутри групп. Например, элементы в одной группе имеют сходные химические свойства, так как имеют одинаковое число валентных электронов и поэтому способны образовывать схожие химические соединения и реагировать с другими веществами.
Другой важной концепцией периодической таблицы является группировка элементов по их электронной конфигурации. Главные группы (I, II, VII, VIII) содержат элементы, обладающие сходными электронными конфигурациями в валентной оболочке. Например, группа VIII содержит инертные газы, которые имеют полностью заполненную валентную оболочку и не образуют химические соединения с другими элементами.
При рассмотрении периодической таблицы также видно, что свойства элементов меняются по столбцам (группам), при этом свойства элементов в одной группе (вертикально) имеют сходства. С помощью таблицы можно определить такие химические свойства, как валентность, электроотрицательность, радиус атома, и многое другое. Также таблица отображает возрастание атомной массы и количество протонов в ядре каждого элемента.
Взаимосвязь элементов в периодической таблице позволяет увидеть закономерности и предсказывать свойства элементов, даже для тех элементов, которые еще не были открыты. Это делает периодическую таблицу не только удобным инструментом для организации и классификации химических элементов, но и важной основой для понимания и изучения химической науки в целом.
Закономерности в периодической системе химических элементов
Периодическая система химических элементов, созданная Д.И. Менделеевым, представляет собой удобный и систематизированный способ классификации химических элементов. В этой системе элементы расположены в порядке возрастания атомных номеров и группированы по их химическим свойствам, что позволяет выявить ряд закономерностей.
Одна из главных закономерностей в периодической системе — закон периодичности химических свойств элементов. Эта закономерность заключается в том, что химические свойства элементов повторяются периодически через определенные промежутки. Так, элементы одной группы (вертикальные столбцы) имеют схожие химические свойства и образуют химические семейства. Например, элементы первой группы — щелочные металлы — обладают высокой химической активностью.
Еще одним важным принципом в периодической системе является закон октаэдрической координации. Согласно этому закону, элементы, находящиеся в одной периоде (горизонтальные строки), имеют одинаковую внешнюю электронную конфигурацию и схожие свойства. Это объясняется тем, что элементы периода имеют одинаковое число электронных оболочек и обладают схожей реакционной способностью.
Также в периодической системе наблюдается закон диагональных соответствий. Согласно этому закону, элементы, расположенные в одной диагонали, обладают сходством во многих свойствах. Например, элементы, которые расположены по диагонали от лития (Li) до фтора (F), образуют так называемую атомную подгруппу, в которой все элементы имеют похожие химические свойства.
Периодическая система химических элементов является мощным инструментом для изучения и понимания свойств и поведения химических элементов. Закономерности в этой системе позволяют предсказывать и объяснять химические реакции, а также разрабатывать новые материалы и вещества с желаемыми свойствами.
Закон добивки групп и периодов
Согласно этому закону, группы и периоды системы химических элементов заполняются постепенно, с добавлением новых элементов по мере увеличения атомного номера. При этом каждый новый элемент заполняет свободные места, расположенные в следующей незанятой группе либо в следующем незаполненном периоде. Таким образом, закон добивки позволяет предсказывать химические свойства элементов в зависимости от их расположения в системе.
Закон добивки групп и периодов также указывает на существование определенных закономерностей в химических свойствах элементов, расположенных в одной группе или периоде. Элементы, относящиеся к одной группе, обладают схожими химическими свойствами, а элементы одного периода имеют сходные химические свойства в связи с постепенным изменением электронной конфигурации.
Таким образом, закон добивки групп и периодов играет важную роль в систематизации и классификации элементов, позволяя упорядочить их по возрастанию атомных номеров и выявить закономерности в их химических свойствах.
Закон изменения свойств элементов в периоде
На самом деле, в периоде от левой стороны таблицы Менделеева к правой происходит постепенное изменение свойств элементов. По мере движения по периоду, электроотрицательность элементов увеличивается, а радиус атомов уменьшается.
На левом конце периода находятся металлы, которые обладают характерными металлическими свойствами, такими как блеск, прочность и хорошая теплопроводность. Свойства металлов как бы достигают пика. Как правило, металлы имеют низкую электроотрицательность и большой радиус атомов.
По мере приближения к правому концу периода, свойства элементов начинают изменяться. В середине периода располагается граница между металлами и неметаллами, которая соответствует полуметаллам или металлоидам. Металлоиды обладают свойствами как металлов, так и неметаллов, их свойства не являются столь выраженными как у чистых металлов или неметаллов.
На правом конце периода находятся неметаллы, которые обладают характерными неметаллическими свойствами, такими как непрозрачность, хрупкость и низкая теплопроводность. Неметаллы имеют высокую электроотрицательность и малый радиус атомов.
Таким образом, закон изменения свойств элементов в периоде демонстрирует систематический порядок и градацию свойств элементов от левого к правому концу периода в таблице Менделеева. Этот закон позволяет определить типы элементов и их свойства на основе их позиции в периоде.
Периодические закономерности в химических реакциях
Одной из важных периодических закономерностей является закон возрастания атомных масс элементов в пределах периода. Это означает, что атомные массы элементов увеличиваются по мере движения слева направо в периоде. Это имеет прямое влияние на химические реакции, поскольку более тяжелые элементы имеют более выраженные химические свойства и могут проявлять себя в более активных реакциях.
Еще одной закономерностью является закон периодических свойств элементов. В периодической системе элементов можно выделить несколько главных групп – группы щелочных металлов, щелочноземельных металлов, переходных металлов и других. Каждая группа элементов обладает своими химическими свойствами и способностью к той или иной химической реакции. Например, щелочные металлы характеризуются высокой реактивностью и способностью образовывать щелочные растворы.
Также в химических реакциях проявляются закономерности атомных радиусов элементов. В периодической системе атомный радиус элемента уменьшается с увеличением атомного номера. Более маленькие атомные радиусы элементов оказывают влияние на силу химической связи и скорость химических реакций. Например, маленькие радиусы элементов группы VIII (периодическая система поперечных периодов) приводят к высокой реактивности и способности к каталитическим реакциям.
Таким образом, периодические закономерности в химических реакциях имеют важное значение для понимания химии элементов и реакций, которые могут происходить между ними. Изучение периодической системы и законов химии позволяет предсказывать химические свойства элементов и проводить более эффективные химические превращения.
Вопрос-ответ:
Какие основные принципы и закономерности лежат в основе периодического закона и периодической системы химических элементов?
Основные принципы и закономерности периодического закона и периодической системы химических элементов включают в себя: упорядочение элементов по возрастанию атомного номера, расположение элементов в порядке возрастания электронной конфигурации, повторяющиеся периодические свойства элементов и группировку элементов схожих свойств в вертикальные столбцы — группы.
Какие элементы являются основными строительными блоками периодической системы химических элементов?
Основными строительными блоками периодической системы химических элементов являются атомы различных химических элементов, которые располагаются в периодах и группах в зависимости от своих химических и физических свойств.
Каким образом следует располагать элементы в периодической системе химических элементов?
Элементы в периодической системе химических элементов следует располагать по возрастанию атомного номера, то есть в порядке увеличения заряда ядра атома. Это позволяет упорядочить элементы по их атомной массе и электронной конфигурации, что в свою очередь отражает закономерности и периодичность химических и физических свойств элементов.
Какие свойства элементов могут быть предсказаны исходя из их положения в периодической системе химических элементов?
Исходя из положения элементов в периодической системе химических элементов, могут быть предсказаны такие свойства, как атомный радиус, ионизационная энергия, электроотрицательность, химическая активность и т.д. В целом, расположение элементов в системе позволяет предсказывать и объяснять множество химических и физических свойств элементов и их соединений.
Каким образом периодический закон и периодическая система химических элементов помогают в изучении строения атома по Д.И. Менделееву?
Периодический закон и периодическая система химических элементов помогают в изучении строения атома по Д.И. Менделееву, так как расположение элементов в системе отражает закономерности в строении атома, включая количество электронных оболочек, электронную конфигурацию и другие физические характеристики. Это позволяет понять долгосрочные закономерности химической реактивности и свойств элементов.
Какие принципы и закономерности лежат в основе периодического закона?
В основе периодического закона лежит идея о том, что свойства химических элементов периодически повторяются с изменением их атомного номера, то есть порядкового номера элемента в периодической системе. Это связано с упорядоченным расположением элементов в периодической системе, где они принято размещать в порядке возрастания атомного номера.